دانشمندان جان هاپکینز به توسعهی روشی پرداختهاند که پس از استفاده از ابزار برش ژن موسوم به کریسپر، از قوانین بازدهی برای معرفی توالیهای جدید DNA در سلولها استفاده میکند. دانشمندان میگویند این روش بر اساس تستهای جنین موش و هزاران سلول انسانی، میتواند به بهبود سازگاری و بازدهی ویرایش ژنوم کمک کند.
روش جدید و توسعهی آن در تاریخ ۲۸ نوامبر در مجلهی Proceedings of the National Academy of Sciences علوم شرح داده شده است. بهگفتهی گرالدین سیدوکس، استاد شلدون هانتینگتون در بخش ژنتیک و زیست مولکولی و معاون تحقیقات دانشگاه جان هاپکینیز، دانشکدهی پزشکی و پژوهشگر مؤسسهی پزشکی هوارد هاگز:
کریسپر ابزاری است که در تغییر ژنوم، پیشبینی خروجی رفتارهای مشخص و مطالعهی آنها به دانشمندان کمک میکند؛ اما این ابزار هم خرابیهایی در ژنوم ایجاد میکند و نحوهی ورود یک توالی جدید DNA به ژنوم را کنترل نمیکند. در نتیجه به بررسی نحوهی ترمیم خرابیهایی که بر اثر کریسپر به وجود آمدهاند میپردازیم تا بتوانیم از فرایند ترمیم طبیعی DNA برای ورود توالیهای جدید در ژنوم استفاده کنیم. به این نتیجه رسیدیم که تا وقتی DNA-های خارجی خطی باشند، سلولها توالیهای DNA خارجی را برای ترمیم خرابیهای DNA کپی میکنند. با مطالعهی نحوهی کپی شدن بخشهای خارجی DNA در طول فرآیند ترمیم، به بعضی قوانین ساده برای بهینهسازی ویرایش ژنتیکی و بهینهسازی ابزار رسیدیم.
کریسپر که مخفف «تناوبهای کوتاه پالیندروم فاصلهدار منظم خوشهای» است، در پنج سال گذشته بهعنوان ابزاری برای برش بهینهی DNA، به محبوبیت زیادی در بین دانشمندان دست یافته است. این روش برای سلولهای پستانداران از یک فرآیند دفاع ویروسی طبیعی در سلولهای باکتریایی تطبیق یافته که شامل برشهای مخرب در DNA ویروسی است. این ابزار یک مجموعهی بهینه از قیچیهای مولکولی است.

باور عمومی دانشمندان این است که سلولها، خرابیهای DNA را از طریق درج یک مجموعهی تصادفی از نوکلئوتیدها ترمیم میکنند؛ نوکلئوتیدها بلوکهای سازندهی شیمیایی DNA هستند. این روند هر ژن واقع در نقطهی خرابی DNA را نابود میکند.
سلولها گاهی از یک منبع متفاوت برای ترمیم خرابی در DNA استفاده میکند، این منبع معمولا یک توالی از بخش دیگر DNA یا «دهندهی» DNA است. با این حال، توالی «دهنده» را نمیتوان در یک فضای خالی ژنوم وارد کرد.
درعوض، DNA دهندهی جدید به یک نوع نوار در هر انتهای خود نیاز دارد که به آن کمک میکند در شکاف برش بچسبد. دانشمندان به این نوار، بازوهای همسانی DNA دهنده میگویند. بازوهای همسانی شامل نوکلئوتیدهایی هستند که بخشهای دستنخوردهی DNA را با کد ژنتیکی منطبق با آن میپوشانند. در نتیجه DNA دهنده میتواند به DNA سالم بچسبد.
با این حال دانشمندان DNA دهنده را یک روش غیر بهینه برای ترمیم ژنوم میدانند؛ زیرا این روش هنگام درج یک توالی طولانی DNA و یک DNA مدور یا استاندارد واحد، به بازوهای طولانی همسان نیاز دارد که آمادهسازی آن در اندازههای طویل دشوار است.
به گفتهی سدیوکس متخصص کریسپر، سؤالهایی در مورد قوانین طراحی بهینهی DNA دهنده و طول بازوهای همسان بهوجود آمده است.
دانشمندان جان هاپکینز به دنبال یافتن پاسخ این سؤالها، به درج ترکیبهای مختلفی از DNA دهنده در سلولهای کلیهی جنین انسانی پرداختند. این سلولها به دلیل توانایی رشد خوب و کاربرد گسترده در تحقیقات سرطان معروف هستند. دانشمندان از DNA دهنده به همراه یک ژن استفاده کردند که به کدگذاری یک پروتئین فلورسنت میپردازند و در نتیجه پس از درج موفقیتآمیز ژن، رنگ سبز درخشانی در غشای هستهای سلول به وجود میآورد.
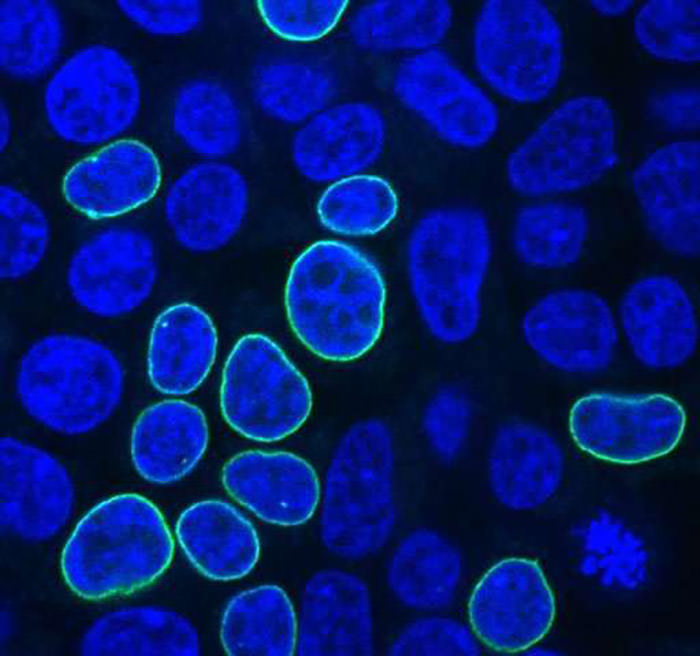
سلولهای کلیهی جنین انسان پس از ترمیم خرابی DNA با قطعهی PCR به رنگ سبز درمیآیند، این خرابی بر اثر کریسپر به وجود آمده است، قطعهی PCR با رمزنگاری یک پروتئین فلورسنت و بازوهای همسان با ۳۳ نوکلئوتید این رنگ سبز درخشان را به وجود میآورد.
آلکساندره پیکس، یکی از دستیارهای تحقیقاتی جان هاپکینز به این نتیجه رسیده است که بخشهای DNA در نقش دهنده عملکرد بسیار خوبی دارند و دو تا پنج مرتبه بهینهتر از DNA-های مدور (موسوم به پلاسمیدها) در سلولهای انسانی عمل میکنند. پیکس میگوید آمادهسازی DNA خطی در آزمایشگاه با استفاده از PCR بسیار ساده است. این روش به ابزار واکنش زنجیرهای پلیمری اشاره میکند که برای تقویت DNA به کار میرود.
پیکس به تست طولهای مختلف بازوی همسان هم پرداخته است. او به این نتیجه رسیده است که طول قسمت مرکزی بازوی همسان، تقریبا ۳۵ نوکلئوتید است که اندکی کوتاهتر از کاربردهای متداول دانشمندان است. به ویژه، بازوهای همسان به طول ۳۳ تا ۳۸ نوکلئوتید به اندازهی بازوهایی با ۵۱۸ نوکلئوتید موفق بودند و به بین ۱۰ و ۲۰ درصد ویرایش موفق تحت شرایط بهینه رسیدند. در مقابل، وقتی دانشمندان به تست بازوهای همسان با ۱۵ و ۱۶ نوکلئوتید پرداختند، نسبتهای موفقیت به نصف رسید. آنها این نتایج را در سه موقعیت مختلف در ژنوم انسانی تکرار کردند. همچنین دریافتند طول توالی جدید درجشده، به غیر از بازوهای همسان، میتواند تا ۱۰۰۰ نوکلئوتید باشد.
این تیم با درجهای متغیر از ۵۷ تا ۹۹۳ نوکلئوتید به نسبتهای موفقیت بین ۱۰ و ۵۰ درصد رسید. درج توالیهای کوتاهتر نسبت به توالیهای طولانیتر موفقتر بود. برای مثال، توالیهای جدید با طول ۵۷، ۷۱۴ و ۹۹۳ نوکلئوتید به ترتیب در ۴۵.۴، ۲۳.۵ و ۱۷.۹ درصد موارد با موفقیت درج شدند. درجهای جدید فراتر از ۱۰۰۰ نوکلئوتید، برای مثال با طول ۱۱۲۲ و ۲۲۲۹ نوکلئوتید در ۰.۵ درصد موارد، با موفقیت اندکی همراه بودند. به گفتهی سیدوکس در این اندازه، وارد کردن کمیت DNA دهنده برای ویرایش کار دشواری است. سلولها تمایل دارند DNA بیشتری ترشح کنند.
در نهایت تیم به این نتیجه رسیدند که نرخ موفقیت ویرایش، در صورت ورود توالی جدید در ۳۰ نوکلئوتید از محل برش کریسپر بالا میرود. به گفتهی سیدوکس:
در صورت وجود بیش از ۳۰ نوکلئوتید، فرآیند درج عملی نیست. این پارامترها بیشترین ژن را برای ویرایش تولید میکنند. در واقع اغلب آزمایشها، تنها ویرایش دو یا سه نوکلئوتید نزدیک به محل برش کریسپر را در نظر میگیرند.
تیم تحقیقات همین روش را برای جنین موش هم تست کردند. با استفاده از یک قطعهی PCR با بازوهای همسانی ۳۶ نوکلئوتیدی، تیم موفق به درج یک توالی به طول ۷۳۹ نوکلئوتید شد که به کدگذاری یک پروتئین فلورسنت در ۲۷ عدد از ۸۷ عدد جنین موش (۳۱ درصد) میپردازد.
تیم تحقیقاتی سیدوکس از قوانین ترمیم هم برای مطالعهی DNA در کرمهای لولهای استفاده میکنند و به بررسی قوانین ترمیم روی دیگر سلولهای انسانی میپردازند. به گفتهی سیدوکس، قبل از تطبیق گستردهی راهبردها باید به تست آنها در انواع سلولهای انسانی و جاندارهای دیگر پرداخت.
.: Weblog Themes By Pichak :.
